Munkánk során a citoszkeleton negyedik rendszereként számon tartott Septinek kifejeződését és funkcióját vizsgáljuk vázizomban illetve az ezt modellező sejtkultúrákban.
A projektben az alábbi specifikus kérdéseket kívánjuk megválaszolni:
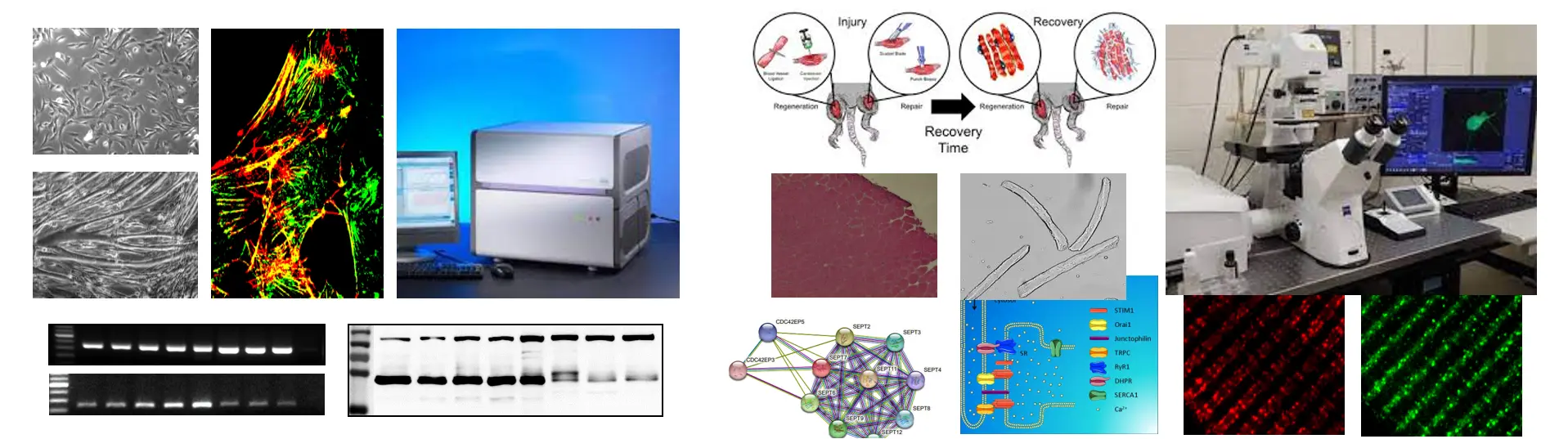
- Részt vesz-e a Septin7 a harántcsíkolt izom regenerációs folyamataiban kontroll (BL6/C57) egerekben?
Sérülést követően a vázizom struktúrája az úgynevezett regenerációs folyamat során áll helyre. A kezdeti gyulladásos választ regenerációs fázis követi, végül az újonnan képződött rostok érése és újraszerveződése zárja a folyamatot. A regenerációs fázis során az izomrostok és a lamina basalis közötti fészekben (niche) található őssejtek (szatellita sejtek) aktiválódnak, az elkötelezett miogén progenitor sejtek egy miogén irányú differenciációs program során mioblasztokká alakulnak, majd struktúrákba szerveződnek (myotube), végül fuzionálnak a sérült rosttal. A regenerációs folyamat kanonikus biomarkere a PAX7, melynek expressziós szintje jó korrelációt mutat a regenerációs folyamat fázisaival. Nemrégiben megjelent tanulmányok a citoszkeletális és intracelluláris kalcium jelátvitelben résztvevő fehérjék összerendeződésében a Septin fehérjék családjának szerepére utalnak.
Az alapkérdés megválaszolásához a különböző Septin izoformák (kiemelten a Septin7 fehérjét) kifejeződését, sejten belüli lokalizációját és más intracelluláris fehérjékkel való kapcsolatát vizsgáljuk C2C12 miogén eredetű sejtvonalon és rágcsálók vázizmain molekuláris biológiai, valamint klasszikus és fluoreszcens hisztológiai módszerekkel (izomsérülés kiváltása BaCl injektálással, RNS- és fehérje izolálás különböző mintákból, vázizom preparátumok és enzimatikusan izolált egyedi vázizomrostok előállítása, RT-PCR, qPCR, western blot, immuncitokémia, immunhisztokémia, konfokális mikroszkópia, immunprecipitáció, tömegspektoszkópia).
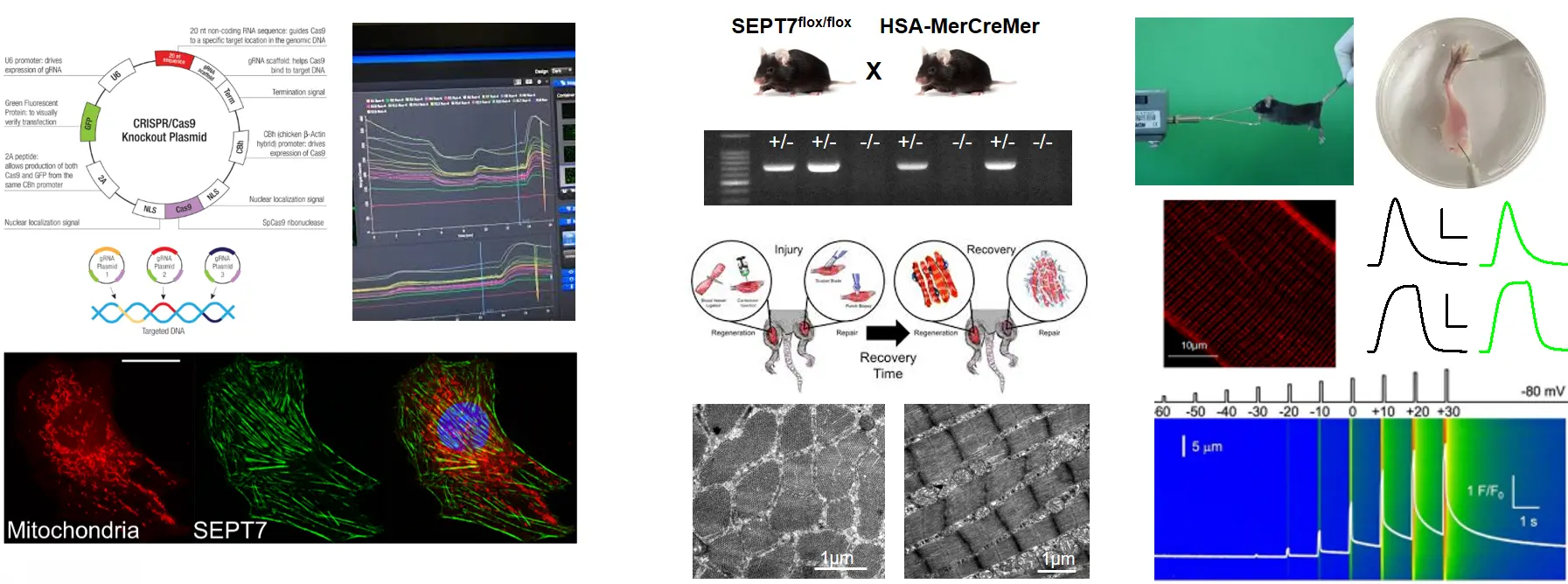
- Módosul-e a regenerációs válasz Septin7 fehérje expressziójának módosítása esetén?
A Septin7 szerepének tanulmányozására a Cre/Lox rendszer segítségével Septin7 parciális knockdown (KD) egereket, illetve sejtkultúrában fenntartott C2C12 sejtek esetében géncsendesítéssel Septin7 knockdown tenyészeteket hoztunk létre. A sejttenyészetben ennek hatására bekövetkező változásokat életképességi, proliferációs vizsgálatokkal, a differenciálódás nyomon követésével, az egerek estében pedig in vivo és in vitro vizsgálatokkal (önkéntes futás, Grip teszt, izomerő mérése), molekuláris biológiai (genotipizálás, RNS- és fehérje izolálás különböző mintákból, RT-PCR, qPCR, western blot) valamint klasszikus és hisztokémiai módszerekkel (vázizom preparátumok és enzimatikusan izolált egyedi vázizomrostok előállítása, immuncitokémia, immunhisztokémia, konfokális mikroszkópia, mitokondriális jelölések, elektronmikroszkópos (TEM, SEM) vizsgálatok), valamint funkcionális kísérletekkel valósítjuk meg (mitokondriális membránpotenciál detektálása, intracelluláris kalciummérés, elektrofiziológia, fáradási protokollok hatásának vizsgálata Live konfokális mikroszkóppal).
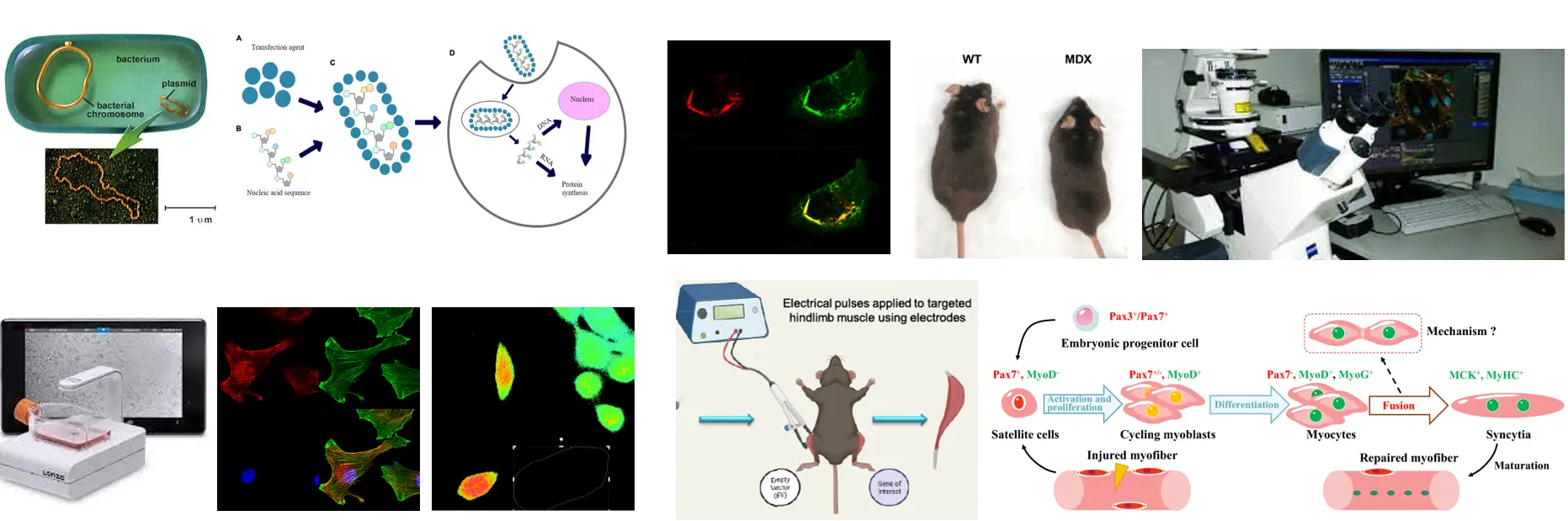
- Mutat-e eltérést a Septin7 expresszió a Duchenne izomdisztrófia egérmodelljének tekinthető MDX egerekben?
A korábbi kísérleteket megismételjük izomdisztrófiás egérmodell rendszerben. Megvizsgáljuk, hogy fluoreszcensen jelölt Septin7 fehérje plazmid expressziós rendszerrel történő kifejeztetése milyen hatással van a vázizom szerkezetére illetve funkciójára. Ehhez bakteriális rendszerben történő plazmid expanziót és izolálást, lipid mediált transzfektálást illetve elektroporációt alkalmazunk.
Sejtkultúrákban a Septin7 géncsendesítés és overexpresszió hatását vizsgáljuk a migrációra, amely során a fluoreszcensen jelölt fehérje intracelluláris lokalizációját és beépülését az endogén rendszerbe konfokális mikroszkóppal, Cytosmart és OperaPhenix mérőrendszerekkel kívánjuk tanulmányozni. Az eredmények alapján a Septin7 citoszkeletális fehérje vázizom regenerációban betöltött szerepének megértése az izomsérülések gyógyításában, illetve a kóros regenerációval járó betegségek kezelésében új terápiás lehetőségeket nyithat meg.
- A kutatócsoport projekthez kapcsolódó publikációi:
Gönczi, M., Dienes, B., Dobrosi, N., Fodor, J., Balogh, N., Oláh, T., Csernoch, L.: Septins, a cytoskeletal protein family, with emerging role in striated muscle. J. Muscle Res. Cell Motil. 42 (2), 251-265, 2021. https://doi.org/10.1007/s10974-020-09573-8
Gönczi, M., Ráduly, Z., Szabó, L., Fodor, J., Telek, A., Dobrosi, N., Balogh, N., Szentesi, P., Kis, G., Antal, M., Trencsényi, G., Dienes, B., Csernoch, L.: Septin7 is indispensable for proper skeletal muscle architecture and function. eLife. 11 e75863, 2022. https://doi.org/10.7554/eLife.75863
- A kutatócsoport projekthez kapcsolódó idézhető absztraktjai és konferenciákon bemutatott tudományos eredmények:
Telek, A., Fodor, J., Dobrosi, N., Szabó, L., Gönczi, M., Dienes, B., Csernoch, L.: Septin-7 is indispensable in skeletal muscle regeneration.J. Gen. Physiol. 154 (9), 1, 2022. https://doi.org/10.1085/jgp.2021ecc33
Gönczi, M., Fodor, J., Telek, A., Dobrosi, N., Ráduly, Z., Szabó, L., Szentesi, P., Dienes, B., Csernoch, L.: The Role of Septin7 in Skeletal Muscle Regeneration. Biophys. J. 120 (3), 96a, 2021. https://doi.org/10.1016/j.bpj.2020.11.792
Csernoch, L., Gönczi, M., Ráduly, Z., Szabó, L., Dobrosi, N., Szentesi, P., Dienes, B.: Essential Role of Septin 7 in Skeletal Muscle Structure and Function. Biophys. J. 118 (Suppl.), 258a, 2020. https://doi.org/10.1016/j.bpj.2019.11.1500
Gönczi, M., Szabó, L., Ráduly, Z., Dobrosi, N., Kis, G., Cseri, K., Dienes, B., Csernoch, L.: Mitochondrial Organization is Severly Modified in Skeletal Muscles of Septin 7 Knockdown Animals. Biophys. J. 118 (Suppl.), 277a, 2020. https://doi.org/10.1016/j.bpj.2019.11.1589
Angyal, Á., Gönczi, M., Ráduly, Z., Szabó, L., Dobrosi, N., Dienes, B., Csernoch, L.: Septin 7 has an essential role in differentiation of C2C12 cells.J. Muscle Res. Cell Motil. 40 (2), 242-243, 2019. http://hdl.handle.net/2437/322063
Dobrosi, N., Szabó, L., Ráduly, Z., Gönczi, M., Kis, G., Cseri, K., Dienes, B., Csernoch, L.: Septin 7 has no role in ec-coupling but severly modifies skeletal muscle architecture. J. Muscle Res. Cell Motil. 40 (2), 250, 2019. http://hdl.handle.net/2437/322060